探索肝细胞癌中的RNA结合蛋白:机制与治疗潜力见解
Hello,各位老师好,今天分享一篇发表在Journal of Experimental & Clinical Cancer Research期刊影响因子11.6分上的题为” Exploring RNA binding proteins in hepatocellular carcinoma: insights into mechanisms and therapeutic potential”即探索肝细胞癌中的RNA结合蛋白:机制与治疗潜力见解的一篇综述。
本综述旨在全面概述RNA 结合蛋白(RBPs)在肝细胞癌(HCC)中的作用。RBPs是一类广泛且异质的转录后调节因子,参与 RNA 的多种过程,包括转录、编辑、剪接、多聚腺苷酸化、运输和降解过程。大量研究表明,作为转录后 RNA 调节因子的组成部分,RBPs 可以导致多种疾病的发生,包括肌肉萎缩、神经退行性疾病和癌症。
肝细胞癌(HCC)是原发性肝癌的主要类型,代表着一个重要的临床挑战。它约占所有肝癌病例的 90%。HCC 是全球第六大常见恶性肿瘤,也是癌症相关死亡率的第三大原因。尽管索拉非尼和瑞戈非尼能够提高生存率,但整体抗肿瘤反应仍然不理想。最近转录组学研究表明,转录组的失调是 HCC 发展的重要驱动因素。失调的 RBPs可以通过影响基因表达导致肿瘤发生。
我们将探讨RBP 在 HCC 中的表达模式和功能意义,特别关注其作为致癌驱动因子或抑癌因子的特征。此外,我们将探讨 RBP 如何参与 HCC 进展的机制,如基因调控、细胞周期控制、上皮间质转化(EMT)、侵袭、血管生成、信号通路和转录后修饰。进一步地,我们将讨论 RBP 作为预后标志物和治疗靶点的潜力,并强调该领域的最新进展和未来方向。
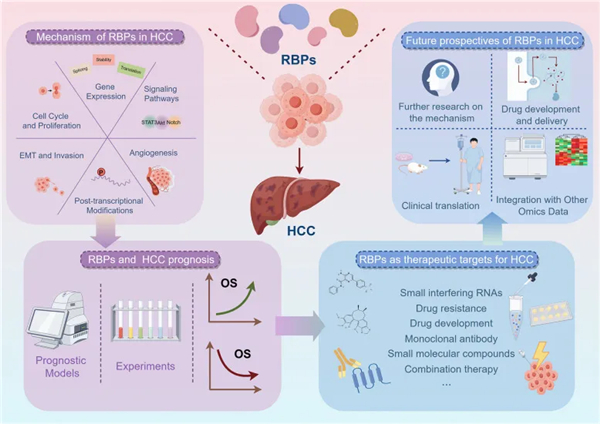
一、RBPs 在 HCC 中的功能与相互作用
在癌症中,RBP 通常根据其对疾病的有利或不利影响分为两大类:促进癌症的 RBP 和抑制癌症的 RBP。RBP 与其靶点之间的相互作用,以及 RBP 与 RBP 之间的相互作用,会影响肝细胞癌(HCC)的进展(见下表)。
|
RBPs<!--?xml:namespace
prefix = "o" ns = "urn:schemas-microsoft-com:office:office"
/--> |
预测靶点 |
表达 |
生物学作用 | |
|
IGF2BP1 |
LINC01093 |
LINC01093 与 IGF2BP1 结合并干扰 IGF2BP1 与 GLI1 mRNA 之间的相互作用 |
抑制肝细胞癌细胞的增殖和转移 | |
|
IGF2BP1 |
miR- 186 |
MiR-186 降低 IGF2BP1 mRNA 和蛋白水平 |
降低肝细胞癌细胞的活力、增殖、迁移和克隆形成能力 | |
|
Otc4 |
survivin/信号转导和 STAT3 通路 |
Oct4 的缺失可以下调 survivin/信号转导和 STAT3 通路的表达 |
Oct4 的下调会显著抑制肝细胞癌细胞的活力、增殖和运动能力 | |
|
Otc4 |
LEF1/β连接蛋白依赖的 WNT 信号通路 |
Oct4 的过表达激活了 LEF1/β连接蛋白依赖的 WNT 信号通路 |
促进肝细胞癌中的上皮间质转化和类似癌症干细胞的特性 | |
|
BARD1 |
Akt、mTOR 和 MMP-9 |
BARD1 的沉默降低了 Akt、mTOR 和 MMP-9 的水平,并抑制了 Akt 和 mTOR
的磷酸化 |
抑制HCC 细胞的增殖、侵袭和迁移 | |
|
CLDN1 |
miR- 29a |
miR-29a 可以下调 CLDN1 的表达 |
抑制肝细胞癌生长和迁移 | |
|
RBM38 |
HOTIAR |
HOTIAR 可以抑制 RBM38 表达 |
促进肝细胞癌细胞的迁移和侵袭 | |
|
RBM38 |
mdm2 和 p53 |
抑制mdm2 表达和恢复野生型 p53 表达 |
抑制肝细胞癌增殖和定植以及在体抑制肝细胞癌肿瘤发生性 | |
|
FUS |
LINC00659 和 SLC10A1 |
LINC00659 招募 FUS 正向调控 SLC10A1 表达 |
抑制HCC 细胞的增殖、迁移和有氧糖酵解 | |
|
FUS |
LATS1/2 |
FUS 促进 LATS/2 的表达 |
抑制肝细胞癌的进展 | |
|
PDCD4 |
miR- 93 |
MiR- 93 下调 PDCD4 的表达 |
促进肝细胞癌细胞的增殖 | |
|
PDCD4 |
miR- 182 |
MiR-182 负向调控 PDCD4 的表达 |
促进肝细胞癌细胞的迁移 | |
|
SORBS2 |
RORA |
SORBS2 减少 RORA mRNA 降解 |
抑制肝细胞癌细胞的增殖、侵袭、迁移和上皮间质转化 | |
二、RNA 结合蛋白对肝细胞癌的机制影响
RBPs 在肝细胞癌中发挥着关键作用。它们通过影响基因表达、细胞增殖、细胞转移、血管生成、信号通路和转录后修饰等多个方面,对肝细胞癌的进展产生影响(见下图)。
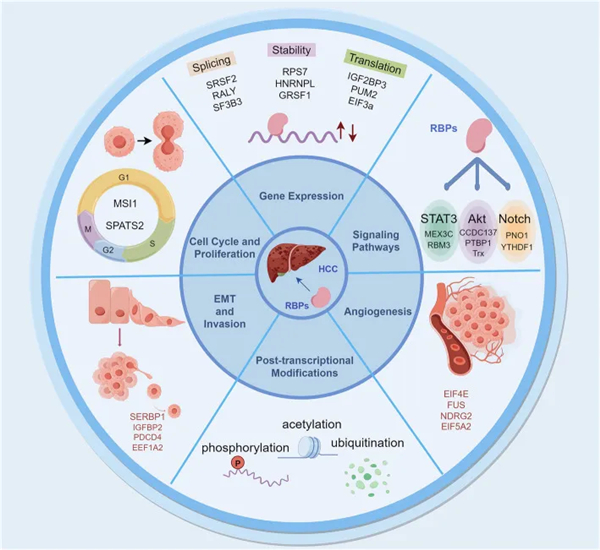
三、RBP 在 HCC 治疗中的潜在作用
RNA 结合蛋白(RBPs)正逐渐成为肝细胞癌(HCC)治疗中的关键要素。它们在多个方面具有潜在的应用价值,包括预后评估、治疗靶点发现以及新型治疗策略的开发。
RBPs 作为预后标志物
RBPs 作为 HCC(见下图)的预后标志物具有相当大的前景。它们在肿瘤组织与正常肝组织中的差异表达和活性通常与疾病进展、预后和患者结果相关。一些 RBPs 在癌组织和癌旁组织中差异表达,这种差异表达与患者预后和临床特征相关。
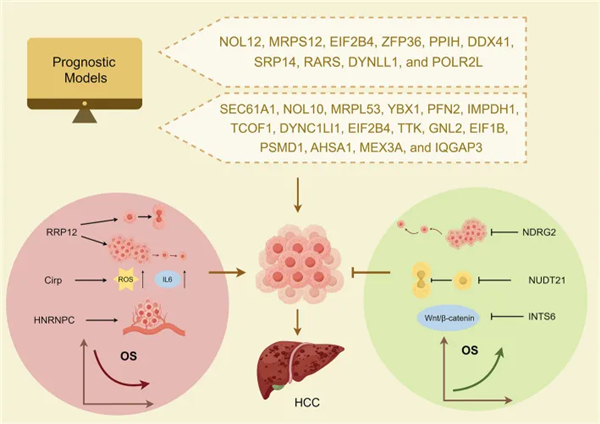
RBP 与 HCC 预后的关系。通过建立预后模型,已识别出大量对 HCC 预后有显著影响的 RBP
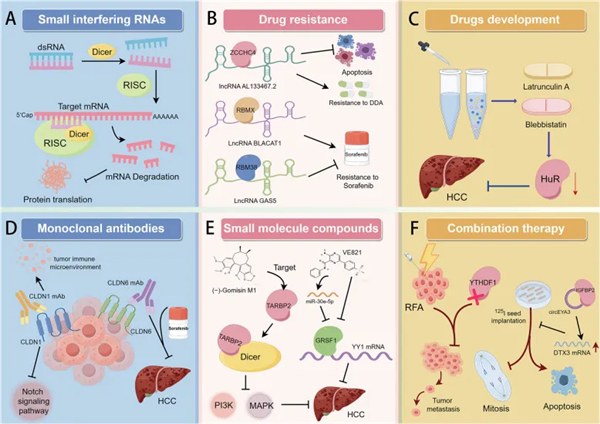
RNA 结合蛋白作为治疗靶点
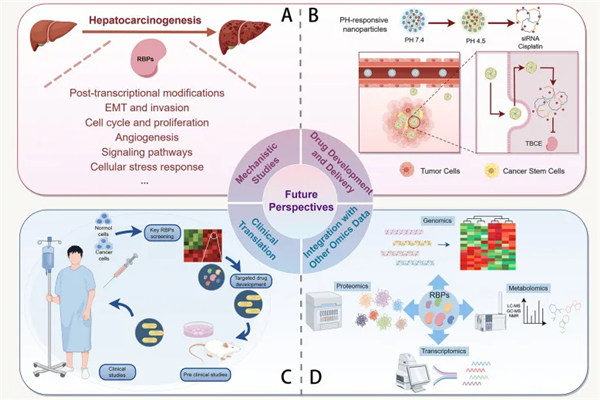
RBPs因其对基因表达和细胞过程的中心调控作用,在HCC的发生和发展中扮演关键角色,因此成为极具吸引力的治疗靶点。RBPs 的异常表达或失调可促进致癌过程,凸显了它们作为癌症精准医疗治疗靶点的潜力。抑制或调节特定 RBPs 的策略可能破坏肿瘤促进通路并恢复正常细胞功能。例如,可设计小分子或基于 RNA 的治疗药物,包括反义寡核苷酸或小干扰 RNA(siRNA),以特异性靶向并抑制过度活跃的 RBPs(下图A)。此外,识别对维持 HCC 细胞存活或抵抗传统疗法至关重要的 RBPs,可能有助于开发新型联合治疗方案,从而增强现有疗法的疗效并克服耐药机制。最近,RBP逐渐被认识到是提高肿瘤耐药性的重要靶点(下图B)。针对RBP 治疗 HCC 的药物也在开发中(下图C)。此外,抗 CLDN6 mAbs 在小鼠 HCC 模型中显示出强大的抗肿瘤作用,并与索拉非尼产生协同效应(下图D)。总之,RBP 作为 HCC 的治疗靶点具有巨大潜力,新的临床前和临床试验正在持续进行。在这些策略中,基于小分子的靶向疗法在肿瘤学研究中正受到越来越多的关注(下图E)。研究发现,在肝细胞癌小鼠模型中,敲低 YTHDF1 能显著抑制亚致死热处理诱导的肿瘤转移。这启发我们探索能结合射频消融术( RFA )和干预关键靶点的新方法,以获得更好的治疗效果(下图F)。
四、未来展望
RBPs 在肝细胞癌的治疗和研究前景中具有巨大潜力。随着我们对肝细胞癌中 RBPs 的认识不断深入,一些关键的研究领域逐渐浮现。对机制进行进一步研究对于深入理解 RBPs 在分子水平上如何影响肝细胞癌至关重要。创新药物递送系统的进步和临床转化成功的前期发现对于开发基于 RBPs 的靶向治疗至关重要,从而弥合基础研究与临床应用之间的差距。此外,将 RBPs 纳入多组学方法可以更全面地了解它们在肝细胞癌中的作用,有可能发现新的治疗靶点和见解。探索 RBPs 的未来前景可以推动肝细胞癌及其他癌症治疗领域的创新和进步。
参考文献:
[1] Ren X, Yang W, Yan X, Zhang H. Exploring RNA binding proteins in hepatocellular carcinoma: insights into mechanisms and therapeutic potential. J Exp Clin Cancer Res. 2025 Apr 24;44(1):130. doi: 10.1186/s13046-025-03395-7. PMID: 40275278; PMCID: PMC12020288.
[2] M MM, N KM. How cells get the message: dynamic assembly and function of mRNA-protein complexes. Nature reviews Genetics. 2013;14(4):275–87.
[3] A C, F B, H MW, P T. RNA-binding proteins in Mendelian disease. Trends in genetics: TIG. 2013;29(5):318–27.
[4] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424.
[5] Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet. 2018;391(10127):1301–14.
[6] Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378–90.
[7] Jiang X, Liu Y, Wang G, Yao Y, Mei C, Wu X, et al. Up-regulation of CLIC1 activates MYC signaling and forms a positive feedback regulatory loop with MYC in Hepatocellular carcinoma. Am J Cancer Res. 2020;10(8):2355–70.
[8] He J, Zuo Q, Hu B, Jin H, Wang C, Cheng Z, et al. A novel liver-specific long noncoding RNA LINC01093 suppresses HCC progression by interaction with IGF2BP1 to facilitate decay of GLI1 mRNA. Cancer Lett. 2019;450:98–109.
[9] Habashy DA, Hamad MHM, Ragheb M, Khalil ZA, El Sobky SA, Hosny KA, et al. Regulation of IGF2BP1 by miR-186 and its impact on downstream lncRNAs H19, FOXD2-AS1, and SNHG3 in HCC. Life Sci. 2022;310:121075.
[10] Wang G, Zhou H, Gu Z, Gao Q, Shen G. Oct4 promotes cancer cell proliferation and migration and leads to poor prognosis associated with the survivin/STAT3 pathway in hepatocellular carcinoma. Oncol Rep. 2018;40(2):979–87.
[11] Sun L, Liu T, Zhang S, Guo K, Liu Y. Oct4 induces EMT through LEF1/β-catenin dependent WNT signaling pathway in hepatocellular carcinoma. Oncol Lett. 2017;13(4):2599–606.
[12] Liao Y, Yuan S, Chen X, Zhu P, Li J, Qin L, et al. Up-regulation of BRCA1-associated RING Domain 1 Promotes Hepatocellular Carcinoma Progression by Targeting Akt Signaling. Sci Rep. 2017;7(1):7649.
[13] Mahati S, Xiao L, Yang Y, Mao R, Bao Y. miR-29a suppresses growth and migration of hepatocellular carcinoma by regulating CLDN1. Biochem Biophys Res Commun. 2017;486(3):732–7.
[14] Ding C, Cheng S, Yang Z, Lv Z, Xiao H, Du C, et al. Long non-coding RNA HOTAIR promotes cell migration and invasion via down-regulation of RNA binding motif protein 38 in hepatocellular carcinoma cells. Int J Mol Sci. 2014;15(3):4060–76.
[15] Ye J, Liang R, Bai T, Lin Y, Mai R, Wei M, et al. RBM38 plays a tumor-suppressor role via stabilizing the p53-mdm2 loop function in hepatocellular carcinoma. J Exp Clin Cancer Res. 2018;37(1):212.
[16] Chen B, Xu X, Wu W, Zheng K, Yu Y. LINC00659 Inhibits Hepatocellular Carcinoma Malignant Progression by Blocking Aerobic Glycolysis through FUS Recruitment and SLC10A1 Modulation. Anal Cell Pathol (Amst). 2023;2023:5852963.
[17] Bao L, Yuan L, Li P, Bu Q, Guo A, Zhang H, et al. A FUS-LATS1/2 Axis Inhibits Hepatocellular Carcinoma Progression via Activating Hippo Pathway. Cell Physiol Biochem. 2018;50(2):437–51.
[18] Huang H, Wang X, Wang C, Zhuo L, Luo S, Han S. The miR-93 promotes proliferation by directly targeting PDCD4 in hepatocellular carcinoma. Neoplasma. 2017;64(5):770–7.
[19] Hu J, Wang Z, Wang J, Jian Y, Dai J, Wang X, et al. MicroRNA-182 Promotes Cell Migration by Targeting Programmed Cell Death 4 in Hepatocellular Carcinoma Cells. Onco Targets Ther. 2020;13:9159–67.
[20] Han L, Huang C, Zhang S. The RNA-binding protein SORBS2 suppresses hepatocellular carcinoma tumourigenesis and metastasis by stabilizing RORA mRNA. Liver Int. 2019;39(11):2190–203.

重庆博纳创源生物科技有限公司
简介:博纳创源专注于生命科学研究领域产品的自主研发与应用,涉及细胞、分子、蛋白、抗体、科研服务、技术咨询等方向。为生命科学研究领域提供创新型解决方案。




