细胞转染:给细胞的“微观快递”如何精准送达?
——科研人必看的避坑指南
一、什么是细胞转染? 细胞转染就像给细胞“送快递”——将外源DNA、RNA等“包裹”精准送入细胞内部,用于基因组功能研究(基因表达调控,基因功能,信号转导和药物筛选研究)和基因治疗研究。
以下是较为常见的一种转染方法的步骤:
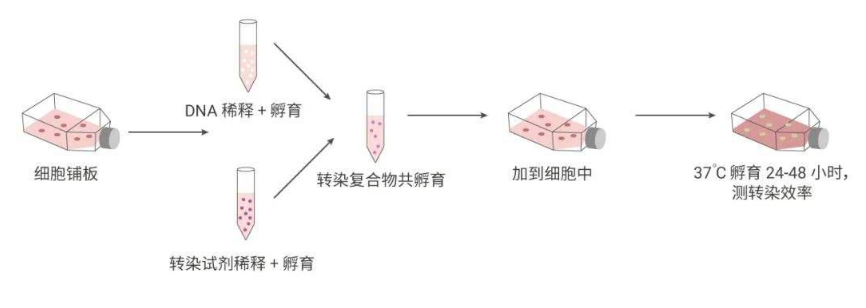
二、转染类型:瞬时转染VS稳定转染
瞬时转染:指通过特定方法将外源基因(DNA、RNA)导入细胞内,但这些外源遗传物质不会整合到宿主细胞的基因组中。因此,随着细胞的生长和分裂,这些外源基因会逐渐被稀释,最终完全丢失,由外源基因所携带的功能也随之消失。瞬时转染通常用于需要快速、短期内观察外源基因表达效果的实验。
稳定转染:指通过特定技术将外源基因(DNA)整合到宿主细胞的染色体中,确保目的基因能够在宿主细胞内长期且稳定地表达。在稳定转染的细胞系中,外源基因的表达会被子代细胞持续表达。
三、3大转染方法,谁是你的“最优解”?
1.化学法
|
转染技术<!--?xml:namespace
prefix = "o" ns = "urn:schemas-microsoft-com:office:office"
/--> |
特点 |
主要应用 |
|
脂质体转染法 |
适用性广 |
瞬时转染/稳定转染 |
|
重复性好 | ||
|
对细胞有选择性 | ||
|
转染效率受细胞类型影响 | ||
|
磷酸钙法 |
操作简单 |
瞬时转染 |
|
重复性差 | ||
|
不能用于原代细胞 | ||
|
EDAE-葡聚糖法 |
对细胞有一定毒性 |
瞬时转染 |
|
一般用于特定细胞 | ||
|
不能用于原代细胞 | ||
|
阳离子聚合物法 |
适用于贴壁细胞和悬浮细胞 |
瞬时转染/稳定转染 |
|
血清会干扰复合物的形成,影响转染效率 |
2.物理法
|
转染技术 |
特点 |
主要应用 |
|
电穿孔法 |
适应性广 |
瞬时转染/稳定转染 |
|
细胞致死率高 | ||
|
转染DNA需求量大 | ||
|
显微注射法 |
操作难度高 |
瞬时转染/稳定转染 |
|
转染细胞数有限 | ||
|
适用范围窄 |
3.生物法
|
转染技术 |
特点 |
主要应用 |
|
腺病毒 |
适用于难转染的细胞 |
瞬时转染 |
|
特定宿主细胞 | ||
|
需考虑安全因素 | ||
|
逆转录病毒 |
适用于难转染的细胞 |
稳定转染 |
|
携带基因不能太大 | ||
|
特定宿主细胞 | ||
|
需考虑安全因素 | ||
|
慢病毒 |
周期长 |
瞬时转染/稳定转染 |
|
特定宿主细胞 |
四、避坑指南:8大翻车现场
1.细胞状态差:选择对数生长期细胞(活性>90%),密度60%-80%最佳。
2.DNA质量低:OD260/280≈1.8,内毒素必须清除!
3.血清干扰:脂质体复合物形成时用无血清培养基,转染后可加回。
4.抗生素作死:转染全程禁用青霉素/链霉素!
5.电压过高:电穿孔参数需预实验优化(250-1250 V/cm)。
6.试剂过期:Lipofectamine 2000开封半年后效率暴跌!
7.忽略细节:DNA-脂质体混合液需轻柔滴加,避免暴力吹打。
8.污染陷阱:支原体污染可让转染效率归零,定期检测!
五、转染后必做:效率检测
· 荧光标记:GFP/RFP报告基因+荧光显微镜观察。
· qPCR/WB:定量目标基因表达水平。
· 阳性对照:共转染荧光质粒,区分“真效率”与“假阴性”。




