手把手教你搞定WB实验!保姆级教程让结果一次成功!
Western blot最全操作详解
WB作为分子生物学中最常用的实验,包含了很多技巧与知识,想做出漂亮的WB检测结果不是一件易事。本文针对WB实验各步骤展开了详细解读如下:
1、WB实验原理
免疫印迹(Immunoblotting)又称为蛋白质印迹(Western Blot,WB),是一种综合性的免疫学检测技术,用于检测细胞或组织提取物中的蛋白表达水平。
这项技术利用待检测蛋白与抗体的特异性结合,测定生物样本中的蛋白水平,已经被广泛应用并得到公认。
目前,WB技术已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。WB实验一般分为SDS-PAGE样本制备、凝胶电泳、转膜、封闭、抗体孵育及免疫检测等步骤。
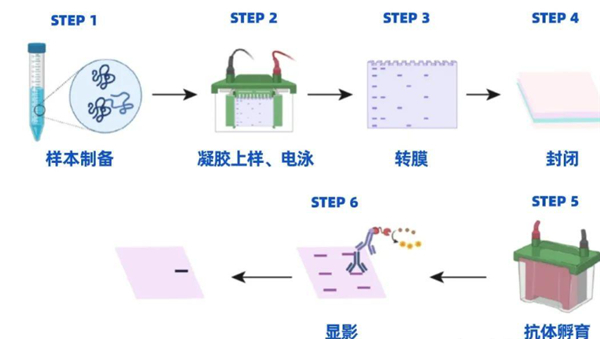
2、WB实验常见流程
WB标准流程:样本制备→凝胶上样、电泳→转膜→封闭→抗体孵育→显影
3、WB实验前准备阶段
实验前需要了解重要信息
实验开始前一定要做的事情,是对所研究的目的蛋白在待测样本中的表达水平、蛋白大小、翻译后修饰等背景信息进行深入的了解,同时也需要设置严格的阴性、阳性对照样本。这将有助于在实验出现异常结果时进行排查分析。
4、WB实验流程重点分享
第一步:样本制备4个步骤
样本制备分为样本获取、蛋白裂解、蛋白定量、蛋白定性等4个关键步骤。
①样本获取:组织或细胞取材;
②蛋白裂解:从组织或者细胞中释放获取蛋;
③蛋白定量:获悉蛋白浓度,为后续电泳步骤提供上样量依据;
④蛋白变性:使蛋白变性形成线性结构,方便跑胶和抗体结合。
第二步:凝胶上样、电泳
操作须知:
① 凝胶制备:
聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术。
②上样与电泳:
a)蛋白预染Marker:采用预染色标记可以看见电泳过程中蛋白迁移的距离,为了便于观察电泳效果与转膜效果,以及判断蛋白分子量大小,在电泳时通常要使用预染的蛋白分子量标准。根据待测蛋白的分子量大小,挑选合适的Marker。
b)加入足量的样品:SDS-PAGE根据蛋白电泳迁移率将其分离,迁移率是蛋白大小和电荷的函数。我们建议在预制Tris-Glycine小孔胶上样20-30μg总蛋白或100ng纯蛋白;对于组织,我们通常建议上样量最多100μg总蛋白,具体取决于靶标表达水平。
c)尽量保持每个泳道的蛋白量一样,体积尽量一致,方便后续观察蛋白的表达量。
d)空置的泳道用等体积的1x Loading Buffer补齐,防止最后的一两个样品条带上扬。
第三步:转膜
转膜原理:
蛋白质经SDS-PAGE分离后,必须及时从凝胶中转移到固相支持物上,固相支持物能牢固结合蛋白又不影响其抗原活性,这使其比直接在凝胶上检测更易操作。蛋白质从凝胶向膜转移的过程常采用电转印法包括湿转和半干转,与SDS结合的蛋白带有负电,在电场中向正极迁移,并最终结合在固相支持物上。
第四步:膜封闭
封闭的目的:
转印结束后,必须将对印迹膜上未被占据的蛋白结合位点封闭掉以防止非特异性探针结合。如果没能将膜上位点全部封闭将会导致印迹膜出现比较高的背景,因为很多检测探针也是蛋白,也会与膜结合。
第五步:抗体孵育
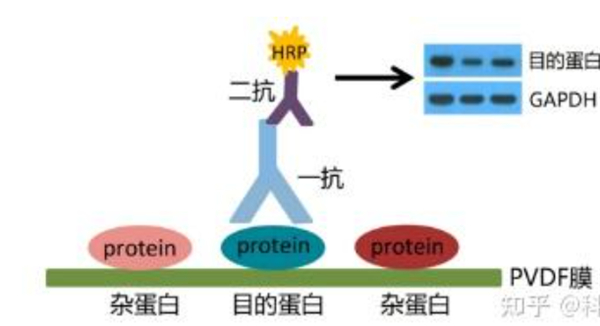
抗体孵育原理:一抗识别膜上蛋白或修饰性抗原表位,二抗识别一抗恒定区从而与一抗结合,最终通过二抗携带的荧光或酶显色信号,达到对样本中目的蛋白进行检测的目的。
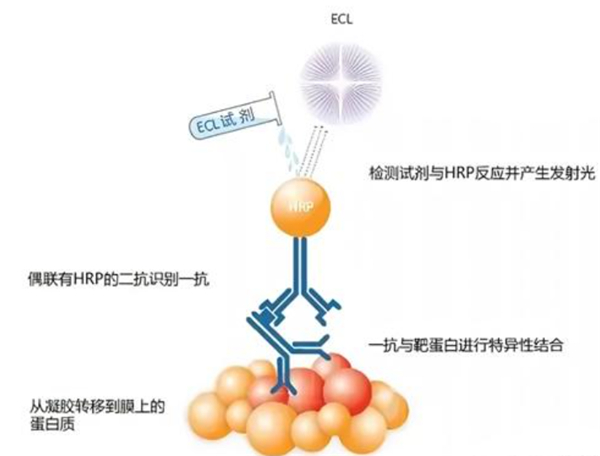
第六步:ECL显影
1)显影的原理
Western Blot实验的最后一步,是显影。拿到高特异性、低背景的显色图像,这一步至关重要。
显色的原理是实验中的二抗被HRP(辣根过氧化物酶)标记,可采用增强化学发光法(ECL)。ECL灵敏度高、重复性好,是目前主流的WB显色方法。
2)具体显影步骤
①在避光环境中,将 ECL 化学发光试剂 A 液、B 液 1:1 配置,充分混匀;
②将 PVDF 膜置于化学发光成像仪载物台上;
③用移液器吸取适量 ECL 混合液滴在 PVDF 膜上,确保工作液均匀覆盖在整张印迹膜上;
④推入载物台,设置曝光时间进行图片采集 (可设置不同的曝光时间采集图像,从中选取曝光效果最佳的图像)。